分光光度法助力探索不同预处理方法 对豆浆抗营养因子含量影响
时间:2021-07-21 阅读:1156
大豆是蛋白质和多种微量营养素的重要来源,并富含大豆异黄酮、大豆甾醇等活性物质,具有较低的血糖指数与较高饱腹感特性[1]。但大豆中还含有多种抗营养因子,包括胰蛋白酶抑制剂(TI)、植酸、单宁、皂甙等。本文利用分光光度法探究大豆不同制浆方法对抗营养因子含量的影响,为豆浆制作方法选择建立依据。
一、材料与方法
1、材料及试剂
大豆、单宁酸、植酸钠、齐墩果酸、牛胰蛋白酶、没食子酸、F-D试剂、碳酸钠、硫酸钠、盐酸、三氯化铁、磺基水杨酸、氯化钠、氢氧化钠、乙酸、乙醇、正丁醇、甲醇、高氯酸、乙酸乙酯、香草醛、氯化钙、Tris-base,F-C试剂,苯甲酰-DL-精氨酸-p-对硝基苯胺盐酸盐(L-BApNA),201×7(717)强碱性苯乙烯系阴离子交换树脂
2、仪器与设备
离子交换柱(ф8mm×10mm),JYDZ-35九阳豆浆机,电子天平,离心机,pH酸度计,UV-5200型紫外可见分光光度计(上海元析仪器有限公司),旋转蒸发仪,水浴恒温振荡器,电热恒温鼓风干燥箱,真空冷冻干燥机等。
3、方法
3.1豆浆制作方法
按市售豆浆蛋白质含量约为2%的浓度,确定豆浆的豆水比为 1:20。浸泡组、干豆组、炒制组、 发芽组共4种豆浆制作处理方式如下:
干豆组:称取50.0g大豆,倒入豆浆机,加水1000mL,制浆程序完成后滤网过滤分离得豆浆。
浸泡组:称取50.0g大豆,加水300mL于室温条件下分别浸泡4h,8h,12h,置于冰箱冷藏(4℃)条件下浸泡12h。浸泡结束后,弃去浸泡水,用吸水材料将大豆表面水分吸干后称量并计算其吸水量,然后补加水至1000mL,倒入豆浆机后制作豆浆。另取一份50.0g大豆经过相同方式浸泡后将浸泡水与大豆分离,保留浸泡水测定其抗营养因子含量。
炒制组:称取大豆250.0g,130℃炒制30min。测定其失水量后,称取与50.0g未炒制大豆等干物质含量的炒制大豆,倒入豆浆机,其后制作方法同干豆组。
发芽组:称取50.0g大豆,加水300mL,30℃浸泡8h后,除去浸泡水后置于遮光处30℃条件下发芽2d,期间每4h淋水一次,发芽结束时芽长平均约为1.5cm。吸干表面水分后,加水1000mL,倒入豆浆机,其后制作豆浆方法同干豆组。
另取干豆,室温浸泡 4h,8h,12h,冷藏浸泡12h后的大豆,炒制后大豆以及发芽后大豆进行冷冻干燥处理并磨粉过100目筛,以测定其中抗营养因子含量。所有样品的抗营养因子保存率按干豆基进行比较。
3.2主要测定方法
3.2.1单宁含量的提取及测定
豆浆与泡豆水直接用1mol/L盐酸调整pH值至4.5±0.1,等电点沉淀大豆蛋白,1500r/min 离心10min,收集上清液进行测定。另分别称取豆渣5.000g 和过100目筛豆粉5.000g,加入去离子水400mL,80℃水浴振荡提取1h,后续步骤同豆浆处理。采用F-D试剂法[2],在680nm 比色测定吸光度。使用单宁酸作为标准试剂,得到回归方程为 y=2.5619x+0.0064,R2 =0.9995。
3.2.2植酸的提取与测定
分别量取豆浆和泡豆水20 mL置于具塞三角瓶中,加入50mL硫酸钠-盐酸提取溶液,振荡提取2h 后,3000r/min 离心10 min,收集上清液,按照国标[3]方法,经阴离子交换柱洗脱提取,收集提取液,在500nm 比色测定吸光度。另取豆渣2.000g 和过100目筛豆粉1.000g,提取方式同豆浆处理过程。使用植酸钠作为标准试剂,得到植酸含量与吸光度的回归方程为 y=-1.165x+0.9427,R2 =0.9995。
3.2.3皂甙的提取与测定
分别量取豆浆与泡豆水20 mL于250 mL三角瓶中,加入75%乙醇100 mL,按照杨秀丽[4]等人方法进行提取、纯化,以5%香草醛-冰醋酸溶液和高氯酸为显色剂,在乙酸乙酯中反应,558 nm 处测定吸光度。豆粉、豆渣处理过程同豆浆。使用齐墩果酸为标准品,得到齐墩果酸量和吸光值的回归方程: y=0.0104x+0.0123。R2=0.9996。
3.2.4胰蛋白酶抑制剂的提取与测定
牛胰蛋白酶放置至室温,精密称1.0000g于200mL容量瓶中,用氯化钙盐酸溶液溶解并定容至刻度。将胰蛋白酶储备液分别稀释为0.5、1.0、1.5、2.0、2.5mg/mL五个浓度,按照国标[5]方法测定吸光度,得到标准曲线,其回归方程为 y=0.1865x+0.0081,R2=0.9999。为保证胰蛋白酶吸光度值为0.380±0.050,得到胰蛋白酶浓度应为1.82-2.38mg/mL,本实验选取2.0mg/mL。
量取豆浆1 mL,加入Tris-氯化钙溶液50mL,于25℃恒温水浴中150r/min 振荡提取2h,3000 r/min离心,取上清液按照不同稀释度进行实验。豆粉与豆渣处理过程同豆浆。将提取液与胰蛋白酶使用液、L-BApNA进行反应,410nm波长处测定吸光度,按照国标所列公式计算样品提取液的抑制百分率和胰蛋白酶抑制剂活性。
3.2.5总多酚的提取与测定
分别量取豆浆和泡豆水10mL,加入50%丙酮10mL,40℃水浴振荡提取4h,用1mol/L盐酸调整pH值至4.5±0.1,等电点沉淀大豆蛋白,1500r/min 离心10min,收集上清液。豆粉、豆渣处理过程同豆浆。采用福林-酚法[6],在765nm处测定其吸光度值。总酚含量以没食子酸当量表示(mg没食子酸/g),以没食子酸为标准品,得到回归方程为 y=0.00189x+0.0012,R2=0.9999。
4、数据处理与统计分析
各指标的测定设3次重复,每次重复平行测定3次,结果用平均值±标准差表示。用SPSS17.0软件处理试验结果,不同前处理方式间差异用单因素方差分析,因素之间的相关分析采用Pearson 相关分析,以P<0.05为显著性差异。
二、实验结果与分析
1、原料前处理方式对豆浆产量的影响
大豆以不同方式进行前处理后,按照豆浆机标准程序制作豆浆,使用豆浆机配套网筛分离豆浆与豆渣,测定豆浆体积与豆渣干重,结果如表1所示。
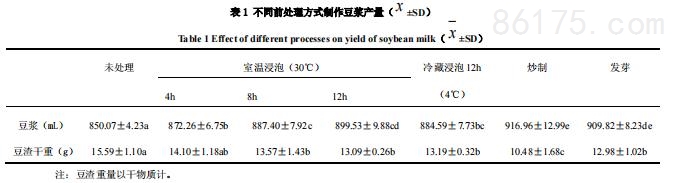
2、未经前处理大豆及制作豆浆中抗营养因子含量
大豆中的抗营养因子含量根据品种、产地、灌溉条件及年份的不同而具有差异[7],本实验中所用大豆中抗营养因子含量如表2所示。

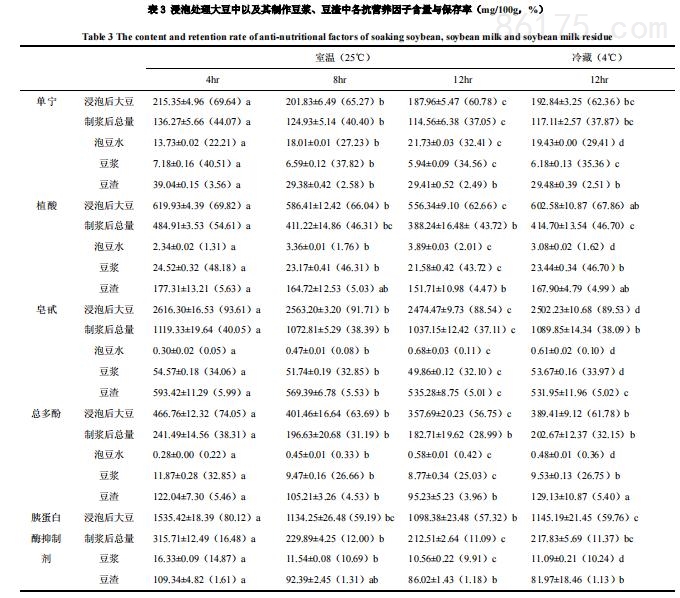
3、浸泡对大豆及其制作豆浆中抗营养因子含量的影响
不同时间及温度去离子水浸泡后的大豆、泡豆水,浸泡后大豆制作的豆浆、豆渣中的抗营养因子含量如表3所示。
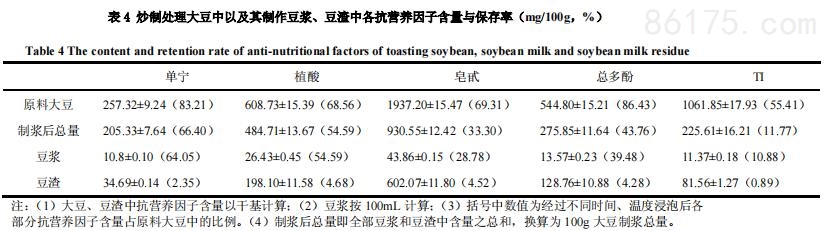
4、炒制对大豆及其制作豆浆中抗营养因子含量的影响
经过炒制后大豆及其制作的豆浆、豆渣中的抗营养因子含量如表4所示。
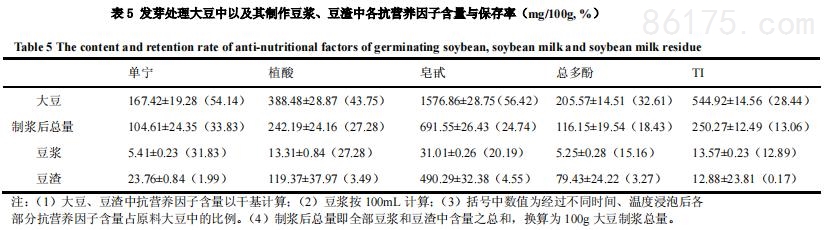
5、发芽对大豆及其制作豆浆中抗营养因子含量的影响
经过发芽后大豆及其制作豆浆、豆渣中抗营养因子含量如表5所示。
三、结论
本文采用分光光度法研究不同大豆预处理方法对豆浆抗营养因子含量影响,研究结果表明与干豆制浆相比,各处理均显著降低了豆浆中抗营养因子的保存率,其中大豆经发芽2d处理后制作豆浆,对各种抗营养因子的消除效果最为显著,浸泡效果次之。对身体缺乏矿物质或消化吸收能力较弱的人,用浸泡或发芽处理的大豆制作豆浆,可能有利于改善营养素的吸收利用。
参考文献:
1、VARDIS D, ANTONIA T. Nutritional and health properties of pulses[J]. Mediterranean Journal of Nutrition and Metabolism, 2009, 1(3): 149-157.
2、候曼玲. 食品分析[M]. 北京: 化学工业出版社, 2004: 137-138.
3、中华人民共和国国家质量监督检验检疫总局. GB/T 5009.153-2003. 植物性食品中植酸的测定[S]. 北京: 中国标准出版社, 2003
4、杨秀丽, 曹艳萍. 大豆皂甙提取工艺的研究[J]. 食品科学, 2006, 27(12): 492-495
5、中华人民共和国国家质量监督检验检疫总局. GB/T 21498-2008. 大豆制品中胰蛋白酶抑制剂活性的测定[S]. 北京: 中国标准出版社, 2008
6、SINGLETON V, LAMUELA-RAVENTOS R. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent [J]. Methods Enzymology, 1999, 29(9): 152-178
7、GUPTA Y P. Anti-nutritional and toxic factors in food legumes: a review[J]. Plant Food for Human Nutrition, 1987, 37(3): 201-228.
文章内容来源于:史海燕,范志红,魏嘉颐.不同预处理对家庭制豆浆抗营养因子含量的影响[J].食品科学,2011,32(17):49-54.
